
电话:029-87679000(总机)
地址:陕西省西安市西五路157号
邮编:710114
网址:www.2yuan.xjtu.edu.cn

电话:029-87679000(总机)
地址:陕西省西安市西五路157号
邮编:710114
网址:www.2yuan.xjtu.edu.cn

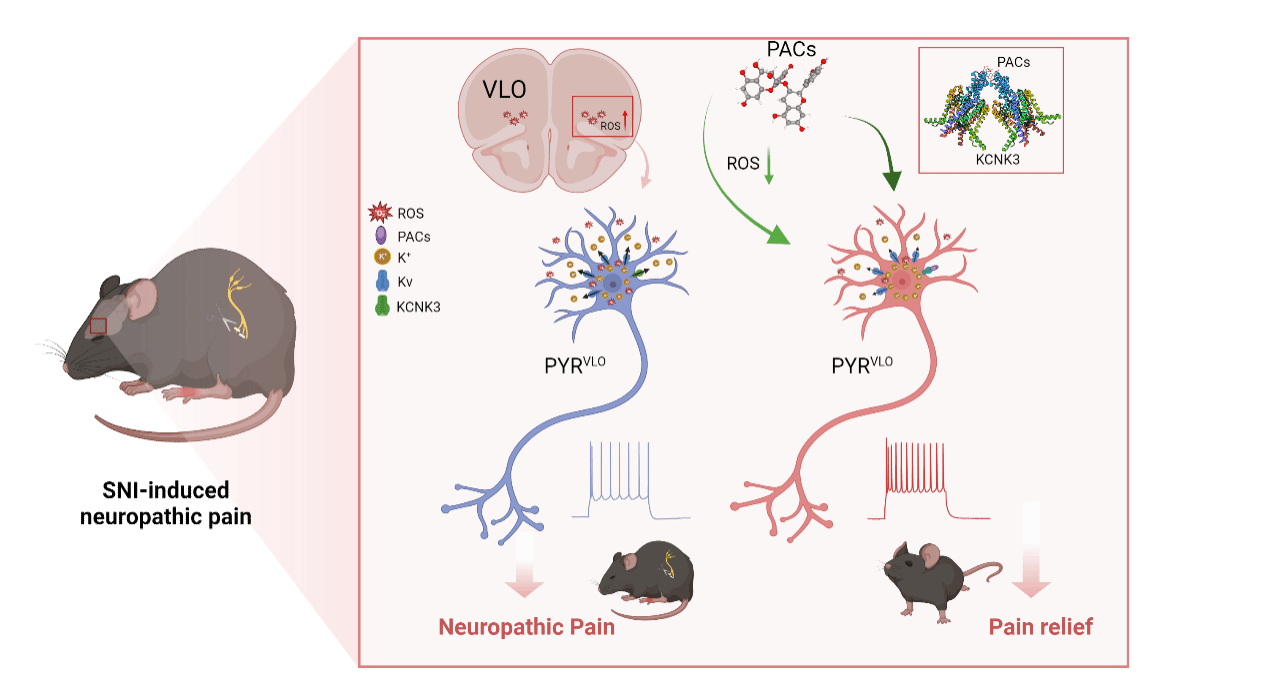
神经病理性疼痛(Neuropathic pain,NP)是一种由神经系统损伤或疾病引起的慢性病理性疼痛状态,通常表现为感觉异常和痛觉过敏,严重影响患者的生活质量。尽管已有大量研究揭示NP的机制,但现有的一线镇痛药物仍面临成瘾性和耐受性等问题,导致疗效与安全性难以兼顾。因此,探索内源性镇痛,有望突破传统药物的局限性,为NP的治疗提供新的思路。腹外侧眶额叶皮层(ventrolateral orbital cortex, VLO)是中枢内源性镇痛的关键脑区,NP时其活性被抑制,但具体机制不明。近年来研究发现,高位皮层的氧化还原失衡参与多种疾病的慢性化过程,但其在中枢镇痛调控中的作用尚不明确。
近日,西安交通大学第二附属医院神经外科屈建强/闫先侠团队联合空军军医大学陈涛教授团队于中科院1区Top期刊《Experimental & Molecular Medicine》杂志(影响因子:12.9)在线发表了题为:Decoding the mechanism of proanthocyanidins in central analgesia: redox regulation and KCNK3 blockade的研究论文,首次揭示了一种天然多酚类化合物——原花青素(Proanthocyanidins,PACs)通过抗氧化应激和靶向钾离子通道双重途径提高VLO兴奋性,实现高效镇痛的作用机制,为慢性疼痛治疗开辟新路径。

团队首先通过行为药理学实验,发现神经病理性疼痛(SNI)模型小鼠VLO区的活性氧(ROS)水平显著升高;通过经鼻给与PACs或VLO局部微注射PACs,均能有效降低VLO区的ROS水平,显著缓解疼痛症状。结合在体多通道电生理记录和离体膜片钳技术,发现慢性痛时VLO内椎体神经元(PYRVLO)的兴奋性显著降低,而PACs能够特异性激活PYRVLO,有效逆转SNI后被抑制的PYRVLO的兴奋性。进一步分析SNI后PYRVLO兴奋性下降的电生理学机制,发现SNI后PYRVLO的抑制与ROS敏感的电压依赖性钾通道(Kv)有关,PACs通过抗氧化作用有效清除过量的ROS,逆转Kv,恢复PYRVLO的兴奋性。
此外,研究团队还发现,PACs除了能逆转SNI引起的PYRVLO抑制(Kv),其本身还影响了PYRVLO的漏钾电流(Ileak),而单纯的ROS清除剂只能阻断PACs对Kv的影响。这提示PACs激活PYRVLO还可能通过独立于抗氧化作用之外的其他机制。团队利用Schrödinger Maestro平台的分子对接技术,发现PACs可直接与KCNK3漏钾通道的离子孔道的帽子结构相结合,结合的方式和位置与KCNK3的商品化阻断剂ML365非常类似。并且,ML365完全阻断了PACs对Ileak的影响。这说明PACs可以通过不同的途径(清除ROS与阻断KCNK3)分别抑制Kv和Ileak来提高PYRVLO的兴奋性。
最后,Kv和Ileak谁占主导,还是两者协同?作者使用改良的Hodgkin-Huxley (HH)模型模拟了SNI和PACs对PYRVLO兴奋性的影响。结果提示,单独减少漏钾电导(gL)或Kv电导均能提高SNI小鼠PYRVLO的兴奋性,但不能完全恢复其兴奋性。当PACs同时抑制Kv和Ileak时,则能完全恢复PYRVLO的兴奋性。说明PACs恢复SNI小鼠PYRVLO的兴奋性、缓解疼痛症状需要2种钾通道的共同参与。
屈建强教授团队长期深耕慢性神经病理性疼痛的临床诊疗与机制研究,在疼痛外科领域积累了丰富的经验。团队依托精准微创外科技术,开展包括微血管减压术、微球囊压迫术、射频消融术及脊髓电刺激术等先进术式,为三叉神经痛、带状疱疹后神经痛、周围神经损伤性疼痛、癌性疼痛等顽固性疼痛患者提供个性化治疗方案。未来,团队将继续融合前沿基础研究成果与临床技术创新,推动疼痛外科治疗的精准化与标准化,为更多疼痛患者带来持久缓解的希望。